Critério 2: Ordenamento das partículas nos diferentes estados físicos.
SÓLIDO
->
*Tem
forma e volumes definidos.
*
As moléculas são MUITO organizadas.
* O
movimento das moléculas é PEQUENO.
LÍQUIDO
->
*Tem
forma e recipiente e volume definido.
* As
moléculas são POUCO desorganizadas.
* O
movimento das moléculas é MÉDIO.
GASOSO
->
* Tem
forma e volume variáveis.
* As
moléculas são MUITO desorganizadas.
*O
movimento das moléculas é GRANDE.
Mudanças
dos estados físicos:
Sólido
para o líquido: FUSÃO
Líquido
para o gasoso: VAPORIZAÇÃO
Gasoso
para o líquido: CONDENSAÇÃO ou LIQUEFAÇÃO
Líquido
para o sólido: SOLIDIFICAÇÃO
Sólido
para o gasoso: SUBLIMAÇÃO
Gasoso
para o sólido: SUBLIMAÇÃO
VAPORIZAÇÃO:
Evaporação
-> * Ocorre a temperatura ambiental.
*
Forma lenta.
*
Exemplos: roupas secando no varal; H2O
Ebulição
-> * Ocorre uma temperatura específica.
*
Varia com a pressão.
*
Forma rápida.
*
Fervura/ bolhas.
Calefação
-> * Forma instantânea (MUITO RÁPIDA)
*
Ocorre quando o liquido se aproxima de uma região muito quente.
*
Exemplos: H2O no ferro quente.
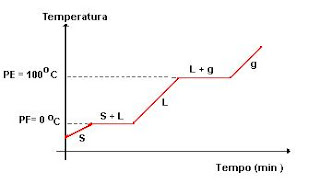
**
Através dos pontos de fusão P.F e ebulição P.E é possível prever o estado físico das
substancias.
ÁGUA: P.F
--> 0°C
P.E --> 100°C
ÁLCOOL:
P.F --> -114°C
P.E --> 78°C
PRESSÃO ATMOSFÉRICA
X P.E pág.43
não aparece nos critérios
SE
DIMINUI PRESSÃO DIMINUI TEMPERATURA.
SE
AUMENTA PRESSÃO AUMENTA TEMPERATURA.
.
Critério 3: Classificar as substâncias como puras e mistas.
Critério 4: Identificar as substâncias como simples e compostas.
Critério 5: Identificar as misturas como homogêneas e
heterogêneas.
SUBSTÂNCIAS
PURAS:
->
Simples: formadas por apenas UM elemento. Exemplo: O2, N2, H2
->
Compostas : formadas por 2 OU MAIS elementos DIFERENTES. Exemplo: H2O, CO2.
MISTURAS:
->
Homogêneas (solução) : apresenta apenas 1 fase. Exemplo: ar atmosférico,
água + álcool.
->
Heterogêneas: apresenta 2 ou mais fases. Exemplo: água + óleo, granito,
sangue.
GRÁFICOS:
PARA
SUBSTÂNCIAS PURAS.
PARA AS
MISTURAS.
MISTURAS EUTÉTICAS.
MISTURAS
AZEOTRÓPICAS.
*FASE: é
a porção uniforme da mistura.
uniforme: 1 coisa só.
*COMPONENTES:
é cada substância pura que participa da mistura.
Critério 6: Identificar os processos de separação de mistura.
*Separação magnética: método de separação em que são aplicados campos magnéticos à mistura para reter partículas que são atraídas por ímãs.
Exemplos:
- Areia e limalha de ferro;
- Utilização de ímã para separar do lixo objetos de metal para serem reciclados.
*Decantação: esse método possibilita a separação de líquidos imiscíveis (que não se misturam) ou permite a separação de um solido precipitado de um líquido. A separação é realizada basicamente pela diferença de densidade.
*Filtração: o processo de filtração é significativamente parecido com o da peneiração, porém, nesse caso, a malha da peneira é mais rebuscada.
Exemplo:
*Filtração: o processo de filtração é significativamente parecido com o da peneiração, porém, nesse caso, a malha da peneira é mais rebuscada.
Exemplo:
- Preparação do café.
Destilação:
SIMPLES: o principio desse processo consiste em aquecer a mistura até a ebulição.
FRACIONADA: o principio dessa destilação é praticamente o mesmo da simples o que diferencia é que neste caso tem-se a mistura de dois ou mais líquidos miscíveis entre si.
Então é isso pessoal, boa sorte na prova quarta!





Nenhum comentário:
Postar um comentário